Preguntas Frecuentes

Una investigación clínica ayuda a los médicos e investigadores a encontrar nuevas y mejores maneras de entender, detectar, controlar y tratar las enfermedades. Los estudios clínicos ayudan a los investigadores a tener más conocimiento sobre la salud e identificar medicamentos, tratamientos o dispositivos médicos nuevos. Hay dos tipos principales de estudios:
- Estudios de intervención, también llamados estudios clínicos, los cuales evalúan medicamentos, tratamientos o dispositivos médicos en seres humanos para saber si son eficaces y seguros para curar, prevenir o controlar ciertas enfermedades.
- Estudios de observación se busca obtener información sobre la salud y las conductas de las personas. En estos estudios clínicos se utilizan encuestas, entrevistas u observación de los participantes en cierto período de tiempo.
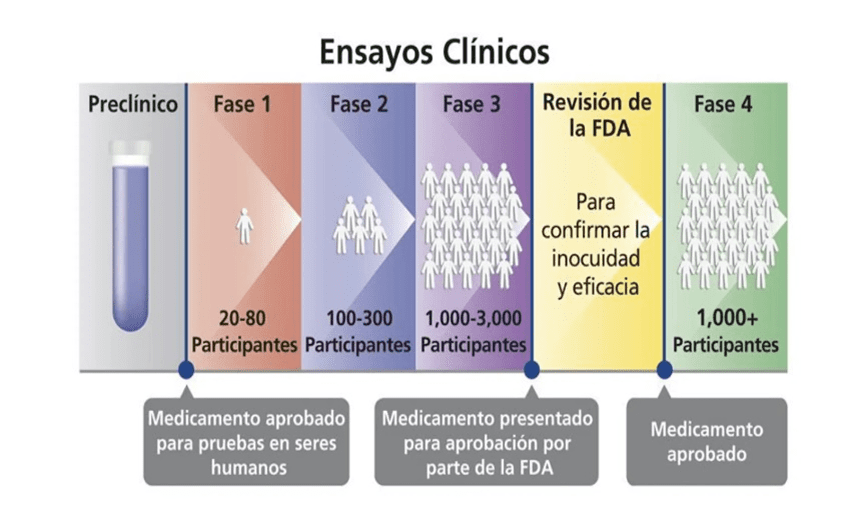
Antes de que un nuevo medicamento, tratamiento o dispositivo médico pueda convertirse en parte del cuidado médico estándar, debe pasar por una fase preclínica y luego distintas fases de investigación clínica. Cada fase de investigación debe:
- responder una pregunta de la investigación.
- cumplir reglas de seguridad antes de avanzar a la siguiente fase.
- lograr los objetivos de la fase antes de la siguiente fase.
Es útil saber en qué fase se encuentra el estudio para entender mejor el propósito de la investigación. Las fases de los estudios de investigación son:
- Fase 1
Los investigadores ponen a prueba un nuevo medicamento, tratamiento o dispositivo médico en un grupo pequeño de personas por primera vez para saber si es seguro, cómo administrarlo y si hay efectos secundarios.
- Fase 2
Se administra el medicamento, tratamiento o dispositivo médico a un grupo un poco más grande de personas que en la fase 1, para estudiar su seguridad más a fondo y su eficacia. A veces, solo unas pocas personas tienen efectos secundarios, por eso es importante evaluar el medicamento, tratamiento o dispositivo médico en un número más grande de personas.
- Fase 3
Se administra el medicamento, tratamiento o dispositivo médico a grupos grandes de personas para confirmar la eficacia y compararlo con otros medicamentos, tratamientos o dispositivos médicos ya aprobados.
- Fase 4
Después de aprobado el medicamento, tratamiento o dispositivo médico para su uso, a menudo se realizan más investigaciones para estudiar la eficacia en varios grupos de personas (por ejemplo, en pacientes a partir de los 12 años) y saber si hay efectos secundarios relacionados con el uso a largo plazo.

Cada estudio clínico tiene unos requisitos específicos que se deben cumplir para poder participar. Estos requisitos son los criterios de elegibilidad. Se evaluará su salud para poder decidir si usted cumple con los requisitos. Deberá firmar un formulario de consentimiento informado antes del proceso de selección. Algunos de los criterios más comunes de elegibilidad son: no estar embarazada o lactando, haber recibido (o no haber recibido) cierto tipo de terapia o vacuna en el pasado, pertenecer a un grupo de edad en específico e historial médico. Si tiene interés en participar en un estudio, se le realizará un examen médico e historial médico y en ocasiones pruebas de laboratorio para garantizar que usted cumple con los requisitos para participar en el estudio.
Existen algunos riesgos por participar, ya sean derivados del medicamento o dispositivo médico del estudio en investigación o de algunas de las evaluaciones y procedimientos médicos que se tienen que realizar. Antes de participar, se le proporcionará un documento llamado Consentimiento Informado que describe los posibles riesgos que existen al participar del estudio de investigación.

El Formulario de Consentimiento Informado es un documento que debe explicar toda la información que una persona razonablemente quisiera saber para decidir si desea participar o no en un estudio de investigación. Además, les proporciona a los participantes información importante, como los riesgos y los beneficios posibles de un procedimiento o tratamiento médico, una prueba genética o un ensayo clínico. Esto se hace para ayudar a los participantes a decidir si se quieren someter a tratamientos o pruebas o participar en un ensayo clínico. Si desea participar en el estudio clínico debe firmar el formulario de consentimiento informado.

Si participa en un estudio de investigación, puede haber un beneficio directo para usted, pero no se pueden brindar garantías. También es posible que no pueda recibir ningún beneficio por estar en un estudio de investigación. Sin embargo, la información del estudio de investigación podría ayudar a otras personas en el futuro.
Usted no debe tener ningún costo por participar en estudios de investigación. Todos los procedimientos relacionados con el estudio de investigación se darán sin costo para usted o su compañía de seguros médicos.

No le diremos a nadie que forma parte del estudio de investigación; solamente su médico de cuidado primario lo sabrá, si usted lo autoriza o es requerido por el estudio.

Por cada visita que usted complete, la clínica del estudio le compensará por su tiempo, los costos de transporte y alimentos asociados al estudio de investigación. La cantidad de dinero que se le reembolsará por visita estará descrita en el consentimiento informado.Si usted no completa el estudio, se le pagará solo por las visitas que haya completado.

El médico del estudio puede retirarlo del estudio sin su permiso sí:
- continuar en estudio podría ser perjudicial para usted,
- no puede seguir las instrucciones del estudio o falta a las citas o
- el estudio puede ser interrumpido por las juntas reguladoras, la Administración de Drogas y Alimentos de los Estados Unidos, FDA, por sus siglas en inglés,o las autoridades reguladoras locales cancelan el estudio.

Su participación en el estudio clínico es completamente voluntaria. Puede escoger dejar de participar en el estudio en cualquier momento. No existe ninguna penalidad o pérdida de beneficios por abandonar el estudio en cualquier momento.

Usted es libre de retirar su consentimiento y dejar de participar en el estudio de investigación en cualquier momento. Negarse a participar no resultará en ninguna sanción ni pérdida de beneficios a los que usted tiene derecho. Y su negativa tampoco afectará sus derechos legales ni la calidad de cuidado médico que usted puede recibir. Se seguirá usando toda la información que ya se haya recopilado acerca de usted como parte del estudio de investigación. No se recopilará ninguna información nueva acerca de usted para fines del estudio de investigación a menos que la información tenga que ver con un evento adverso (efecto malo) relacionado con el estudio de investigación.
A usted se le dará toda información nueva e importante que llegue a estar disponible durante su participación en el estudio de investigación y que pudiera afectar la salud, seguridad o voluntad de seguir en el estudio de investigación.

En la página http://www.ClinicalTrials.gov estará disponible una descripción de los estudios clínicos, conforme a lo exigido por la legislación de los Estados Unidos. Esta página web no incluirá información que pueda identificar a los participantes. A lo sumo, la página web incluirá un resumen de los resultados del estudio. Puede realizar búsquedas en esta página web en cualquier momento.

Si su hijo(a) es menor de 21 años puede participar en los estudios clínicos, pero con el consentimiento de su padre, madre o tutor legal. Además, su hijo(a) debe firmar un formulario de asentimiento que le ofrece información acerca del estudio de investigación. Un miembro del personal del estudio de investigación estará disponible para contestar las preguntas de usted y/o su hijo(a). Su hijo(a) puede elegir si participará o no en el estudio. Si su hijo(a) acepta participar, es necesario que firme un formulario de asentimiento.
Debe traer el certificado de nacimiento de su hijo(a), documento legal de tutela e identificación con foto. Si su hijo(a) está emancipado no necesita su permiso para participar en los estudios de investigación.

Tiene derecho a la privacidad. Toda la información obtenida de la investigación que lo pueda identificar permanecerá confidencial dentro de los límites de la ley.

El consentimiento informado deberá proveer la información de cuantas personas participaran en el estudio.

El consentimiento informado deberá proveer la información sobre la duración del estudio.

Para preguntas sobre este estudio o una lesión relacionada con la investigación, puede contactar:
· Investigador Principal del estudio o a algún miembro del personal del estudio.
Para preguntas acerca de sus derechos como participante en la investigación debe contactar a:
· Junta de Revisora de la Institución, IRB por sus siglas en ingles. La información de número de teléfono y dirección se encuentra en el consentimiento informado.
